Blog
Análises laboratoriais em carboidratos
análises,laboratorial,carboidratos
Análises em carboidratos, como o método de
Fehling, oferecem insights importantes sobre a presença e quantidade desses
compostos em amostras, permitindo uma avaliação precisa de sua composição.
A macromolécula mais abundante encontrada na
natureza é o carboidrato. Desempenha um papel essencial na biologia e nutrição
e é uma das principais fontes de energia para os seres vivos. Para a
compreensão da sua estrutura, composição e função, são necessárias análises
laboratoriais especificas. Nesse texto, exploraremos a definição, composição,
funções e métodos de determinação de carboidratos, com enfoque no método de
Lane-Eynon.
O QUE
SÃO CARBOIDRATOS?
Carboidratos são biomoléculas que constituem os
seres vivos, assim como os ácidos nucleicos, proteínas e os lipídios. São
conhecidos como hidratos de carbono, açúcares ou glicídios, além de serem
fontes de energia, também são fundamentais em diversos processos biológicos.
São compostas por átomos de carbono (C),
hidrogênio (H) e oxigênio (O), na proporção de 1:2:1, representados pela
fórmula geral CH2O, sua estrutura química básica consiste em cadeias
ou anéis formados por unidades de monossacarídeos, que são os blocos de
construção dos carboidratos. Alguns carboidratos podem apresentar outros tipos
de átomos nas suas moléculas, como ocorre com a quitina, que possui átomos de
nitrogênio.
Existem três classes principais de
carboidratos, os monossacarídeos, dissacarídeos e polissacarídeos, que serão
divididos de acordo com a quantidade de átomos de carbono em suas moléculas. Veremos
mais detalhes a seguir.
MONOSSACARÍDEOS:
OS CARBOIDRATOS MAIS SIMPLES
Os monossacarídeos ou açúcares simples, são os
carboidratos mais simples, de onde derivam todas as outras classes. São
constituídos por uma única molécula de açúcar, com três a sete átomos de
carbono, geralmente na forma de cadeia ou anel.
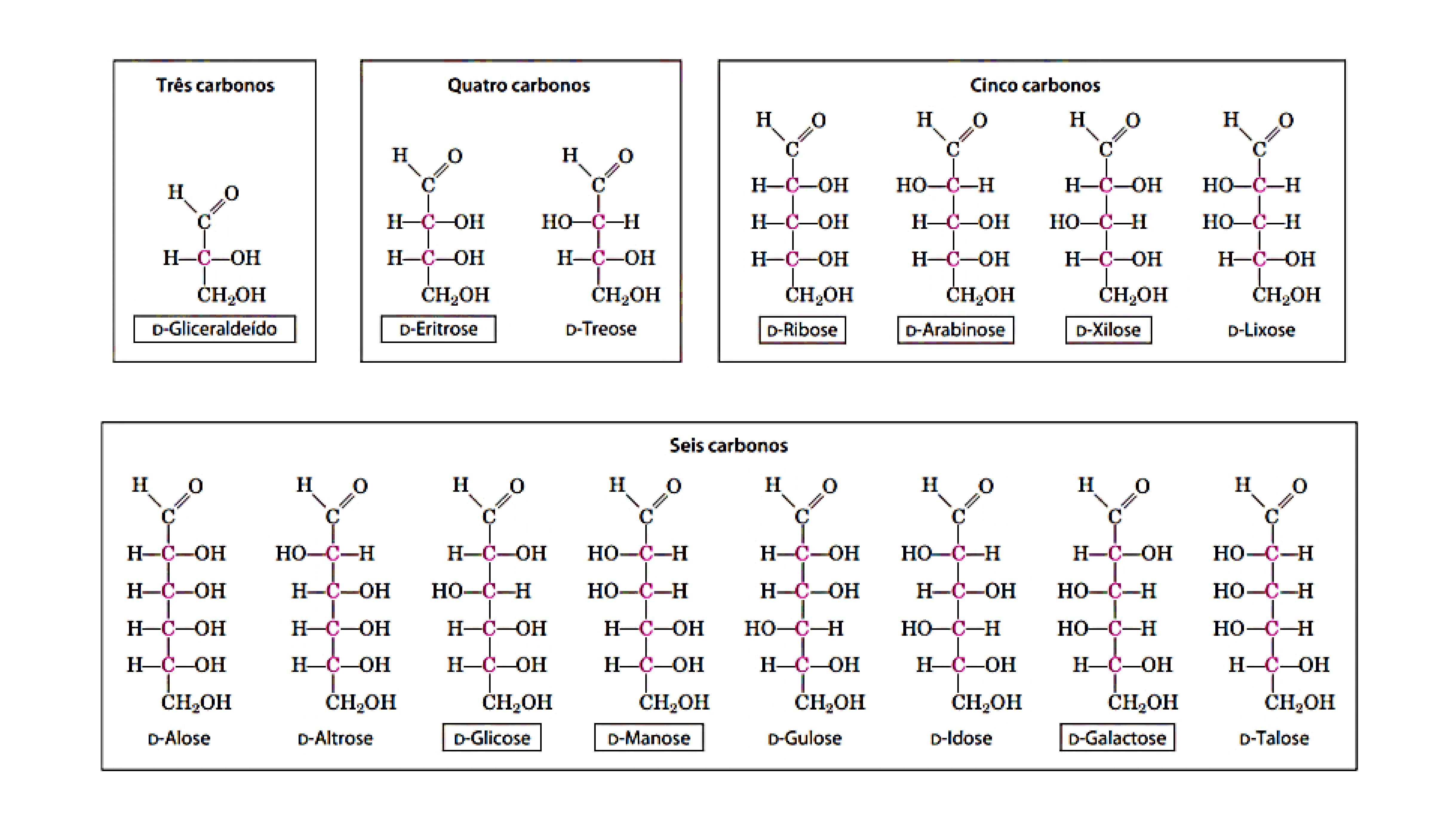
Figura 01. Monossacarídeos do tipo Aldoses. Fonte:
Rafael Salomão da Silva, 2022.
Os monossacarídeos mais comuns são a glicose,
frutose e galactose. A glicose se caracteriza por ser a principal fonte de
energia para o corpo humano, pode ser encontrada em uma grande variedade de
alimentos, como grãos, vegetais e frutas. Já a frutose é encontrada em frutas e
mel, e a galactose não é tão comum, estando presente em laticínios e outros
produtos alimentares.
Entre as funções dos monossacarídeos, está a
síntese de outras substâncias, como os ácidos nucleicos, glicoproteínas e
glicolipídios, além de também serem usados na síntese de glicogênio
(armazenamento de energia em animais) e amido (armazenamento de energia em
plantas).
E sobre os dissacarídeos já ouviu falar? Eles se
diferem porque são compostos por duas moléculas de monossacarídeos.
DISSACARÍDEOS:
LIGAÇÃO DE DUAS MOLÉCULAS DE AÇÚCAR
Os dissacarídeos são carboidratos formados pela
união de dois monossacarídeos, através de uma ligação glicosídica, que ocorre
durante processo de desidratação, liberando uma molécula de água.
A sacarose é um dos dissacarídeos mais
conhecidos, presentes nos açúcares de mesas, e é composta por uma molécula de
glicose e uma de frutose, sendo encontrada em alimentos doces, refrigerantes,
cana-de-açúcar e açúcar refinado. São importantes fontes rápidas de energia na
dieta humana, facilmente metabolizados pelo corpo humano e desempenham diversos
papéis biológicos essenciais.
A lactose é outro dissacarídeo importante,
encontrada no leite e seus derivados, sendo a principal fonte de carboidrato do
leite materno, é composta por uma molécula de glicose e uma de galactose e
precisa da presença da enzima lactase para ser digerida e absorvida pelo
organismo. Pessoas apresentam intolerância à lactose devido à baixa produção de
lactase.
Além da sacarose e lactose, há outros
dissacarídeos, como a maltose que é formada por duas moléculas de glicose e a
trealose que é formada por uma molécula de glicose e uma de frutose. Também são
importantes fontes de energia na dieta humana e estão presentes em cereais,
tubérculos e algumas frutas.
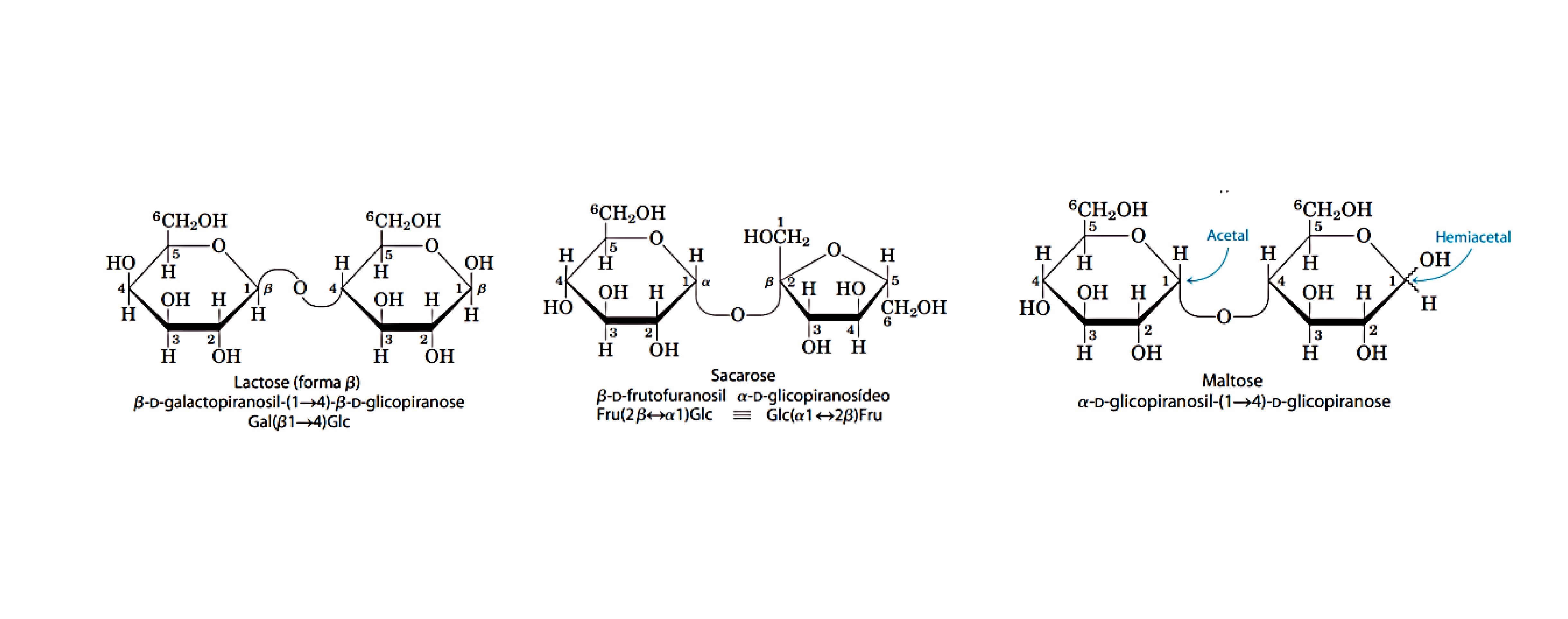
Figura 02. Os principais polissacarídeos: lactose,
sacarose e maltose. Fonte: Rafael Salomão da Silva, 2022.
POLISSACARÍDEOS:
CARBOIDRATOS COMPLEXOS
Os polissacarídeos ou glicanos são
macromoléculas formadas pela ligação de muitas unidades de monossacarídeos,
conectadas por meio de ligações glicosídicas, são carboidratos complexos. Os
polissacarídeos mais importantes são o amido, glicogênio e celulose.
O amido é formado por moléculas de glicose ligadas
entre si e é um dos polissacarídeos mais abundantes na natureza, encontrado em
plantas e atua como uma reserva de energia. Quando consumido, fornece energia
aos organismos pois no processo digestivo é quebrado em moléculas de glicose.
A celulose é um componente estrutural
encontrado nas paredes celulares das plantas, que confere rigidez e resistência
as estruturas vegetais, que é crucial na manutenção da estrutura e suporte das
plantas. Como ocorre no amido, também é um polímero de glicose, porém com
ligações do tipo b, que forma fibras insolúveis em água e que não são digeridas
pelo ser humano.
Outro polissacarídeo importante é o glicogênio,
responsável por ser reserva da célula animal, armazenado no fígado e músculos e
usado como fonte rápida de glicose. Semelhante ao amido, mas com número de
ligações maiores. Os polissacarídeos, em resumo, desempenham várias funções
biológicas, de armazenamento de energia, suporte estrutural e fornecimento de
substratos metabólicos.
MÉTODOS
DE ANÁLISES LABORATORIAIS EM CARBOIDRATOS
Diversos são os métodos usados para análises em
carboidratos (açúcares), dentre os mais comuns se destacam a cromatografia, a espectroscopia
e a titulação. Vejamos abaixo:
CROMATOGRAFIA
A cromatografia é uma técnica que separa
os componentes de uma mistura com base em suas propriedades de interação com
uma fase estacionária e uma fase móvel. Na cromatografia líquida de alta
eficiência (HPLC), a fase móvel (solvente líquido) é bombeada através de uma coluna, enquanto a fase estacionaria
(resina porosa ou partículas revestidas) retém os componentes da amostra. Enquanto
a fase móvel flui pela coluna, os componentes são retidos e separados pela fase
estacionária, permitindo a detecção.
Com a cromatografia gasosa (GC), os carboidratos são convertidos em derivados voláteis antes da análise. A amostra é injetada em um injetor aquecido, é vaporizada e injetada na coluna cromatográfica. Dentro da coluna, os componentes da amostra são separados com base em suas interações com a fase estacionária e detectados posteriormente.
ESPECTROSCOPIA
Já a espectroscopia envolve a medição da interação da luz
com a amostra, o que permite quantificar as substancias com base na absorção ou
transmissão de luz em diferentes comprimentos de onda. Em análises de
carboidratos, esse método aproveita as propriedades especificas de absorção de
luz por certos grupos funcionais que estão nas moléculas.
Para a análise, a amostra com os carboidratos
deve ser preparada e diluída de acordo com a metodologia escolhida. Posteriormente,
a amostra é medida em espectrofotômetro em uma série de comprimentos de onda
específicos, a luz passa pela amostra e a quantidade de luz absorvida pelos
carboidratos presentes é registrada pelo espectrofotômetro. A absorbância
registrada é comparada com uma curva padrão previamente construída, usando
soluções padrões de carboidratos em concentrações conhecidas.
TITULAÇÃO
Titulação é o método clássico que envolve a
adição gradual de um reagente de concentração conhecida a uma amostra até que a
reação química específica ocorra. Esses métodos são essenciais para determinar
a quantidade, a composição e as propriedades dos carboidratos em uma variedade
de amostras, de alimentos e bebidas, até produtos farmacêuticos e biomateriais.
A escolha do método mais adequado depende das características específicas da
amostra e dos objetivos da análise.
Na titulação redox com uso de um indicador colorimétrico a amostra contendo o carboidrato de interesse é adicionada ao reagente mantido sob ebulição até que ocorra a mudança de cor, indicando o ponto final da reação. Este método é frequentemente utilizado para determinações de carboidratos redutores, como a glicose, usando as soluções de Fehling ou de Benedict.
Na titulação de açúcares redutores,
frequentemente se usa o método Lane-Eynon (Fehling), veremos mais detalhes
desse método a seguir.
MÉTODO
LANE-EYNON
O método de Lane-Eynon, também conhecido como
método de Fehling, é uma técnica analítica usada para determinar a presença de
açúcares redutores em uma determinada amostra, e é utilizado em laboratórios de
alimentos, bebidas e bioquímica.
Esse método envolve o uso de duas soluções,
denominadas de solução de Fehling A e solução de Fehling B. A solução A é de
sulfato de cobre (II) em meio ácido, enquanto a B é uma solução alcalina de
tartarato de potássio e hidróxido de sódio. As suas soluções devem ser
preparadas separadamente e mantidas em frascos escuros, pois são sensíveis à
luz.
O teste de Fehling envolve a adição da amostra à
solução de Fehling A e aquecimento para oxidar o carboidrato, reduzindo o íon
cúprico, para formar óxido de cobre (I) insolúvel, na cor vermelha ou alaranjada.
Em seguida, a solução de Fehling B é adicionada, formando um complexo azul de
íon de cobre (II) e tartarato que indica a presença de açúcares redutores. A
intensidade da cor está relacionada à concentração de carboidratos, o que
permite a determinação semi-quantitativa da concentração de carboidratos.
Para verificar o término do processo, pode-se
empregar azul de metileno, cuja forma reduzida é incolor. No entanto, é importante
o processo não exceder 3 minutos, pois qualquer tempo além desse resultará na
decomposição dos açúcares e do próprio azul de metileno, especialmente durante
o aquecimento prolongado entre 105 a 110°C.
Para a otimização do procedimento, a Tecnal
desenvolveu o Determinador de açúcares redutores, modelos TE-0861 e TE-088, com base no método de Lane-Eynon. Com
o uso desse equipamento é dispensada a utilização de acessórios adicionais, como o bico de Bunsen, então se
obtém maior segurança na realização das análises, e o aquecimento por vapor
facilita a troca de calor mais uniforme.
O modelo TE-088 possui um eletrodo de platina, que substitui o azul de metileno para a indicação do ponto final da
titulação, isso garante precisão do método, quando comparado ao método
tradicional, assim pode ser visualizado o ponto de inflexão por escala
numérica, não dependendo da mudança de cor da solução.
Para a utilização desses equipamentos é
necessário o extrato pronto para titulação e para determinação de açúcares
totais é preciso da realização prévia da hidrólise ácida. O determinador de
açúcares redutores deve ser previamente aquecido, depois é adicionada as
soluções de Fehling na cuba, completando com água até cobrir o eletrodo. Posteriormente,
o potenciômetro é acionado, e quando a ebulição das soluções é completa deve-se
iniciar a titulação da amostra que está na bureta.
Outros equipamentos que podem ser utilizados
nesse processo: balança de precisão, balança analítica, dessecador, destilador de água, medidor de pH e banho maria
Quer saber mais? Baixe o e-book exclusivo de "Açúcares Redutores" produzido pela Tecnal! Nele você encontra definição, importância, métodos de determinação, como a análise é feita e as suas vantagens.
CONSIDERAÇÕES
FINAIS
Ao decorrer desse texto, vimos sobre a
definição, funções, tipos de carboidratos, e os métodos utilizados em sua
determinação. Os métodos como cromatografia, espectroscopia, titulação e método
de Fehling (Lane-Eynon) são ferramentas valiosas para industrias e pesquisa,
pois permite uma análise precisa e confiável dos carboidratos em diversas
amostras.
Portanto, compreender as técnicas de análise
laboratorial em carboidratos é fundamental para garantir a qualidade e segurança
dos produtos que consumimos e utilizamos em nosso dia a dia e para pesquisas na
área.
REFERÊNCIAS
BIBLIOGRÁFICAS
CAÑIZARES, G. I. L.; RODRIGUES, L.; CAÑIZARES,
M. C. Metabolismo de carboidratos não-estruturais em ruminantes. Archives of
veterinary Science, p. 63-73, 2009.
CORSINO, J. Bioquímica - Campo Grande,
MS: Ed. UFMS, 213 p. 2009.
GARDIN, J. P. P. et al. Metodologia de
determinação de açúcares solúveis em tecido vegetal de cafeeiro por
cromatografia gasosa. Simpósio de Pesquisa dos Cafés do Brasil, 2005.
MARQUES, M. R. F. Bioquímica, 1. ed. Revisada - Florianópolis: BIOLOGIA/EAD/UFSC, 2014.
MATOS FILHO, H. A.; CARVALHO, R. de C. M.
Análise de carboidratos solúveis em plantas de arroz. Científic@-Multidisciplinary
Journal, v. 7, n. 1, p. 1-8, 2020.
PAULI, E. D.; CRISTIANO, V.; NIXDORF, S. L.
Método para determinação de carboidratos empregado na triagem de adulterações
em café. Química Nova, v. 34, p. 689-694, 2011.
TECNAL. Açucares redutores. Piracicaba:
Tecnal, p. 12, E-book. 2022.








