Blog
8 preguntas clásicas sobre la digestión en el análisis de proteínas
digestión,análisis,proteinas
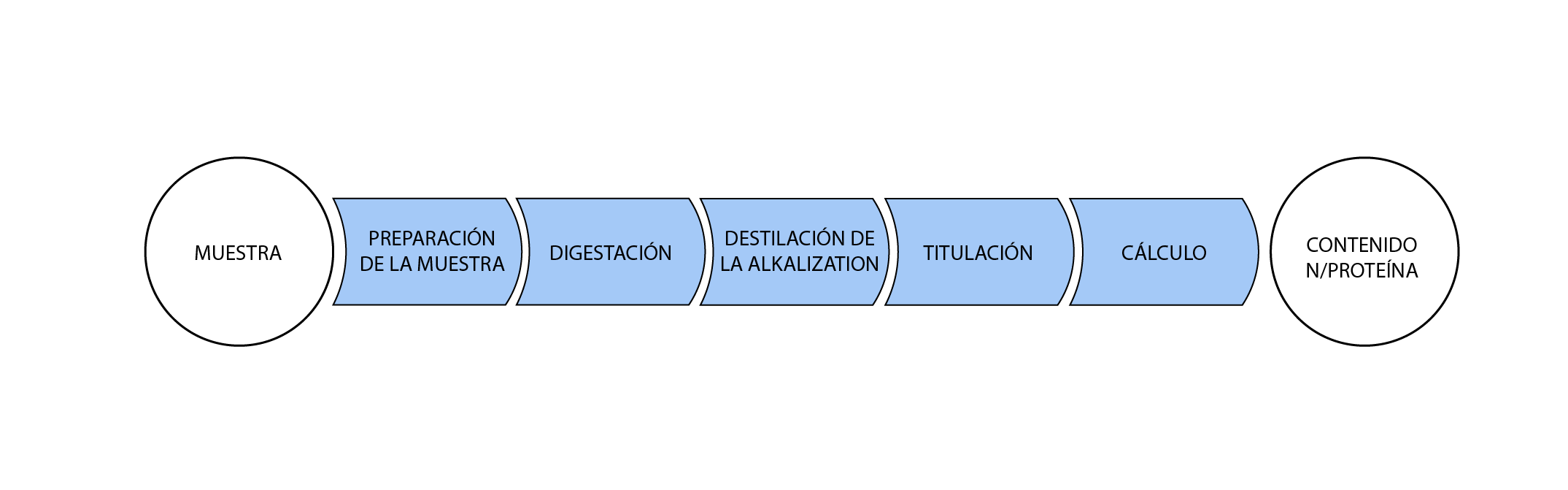
La digestión
es el primer paso del análisis de proteínas por el método Kjeldahl y
ocurre después del muestréo y preparación de la muestra.
El método de
determinación de nitrógeno total fue desarrollado hace más de 130 años
por el danés Johan Gustav Kjeldahl y desde entonces ha sido estudiado,
modificado y mejorado. El método Kjeldahl es una referencia o estándar
para cuantificar el contenido proteico en los alimentos, siendo recomendado por
organismos estandarizadores como AOAC e ISO. Este método cuantifica el contenido
total de nitrógeno y estima indirectamente el contenido proteico de los
alimentos.
Método Kjeldahl
El método
consiste en una digestión con ácido sulfúrico concentrado y una mezcla
catalítica para acelerar la reacción, seguida de una destilación con
hidróxido de sodio para liberar el ion amonio que se encuentra retenido en el
ácido bórico.
El último paso
es la titulación con ácido fuerte estandarizada para cuantificar el
nitrógeno total presente en la muestra. Luego, el contenido de proteína
se estima indirectamente a través del cálculo multiplicando el contenido de
nitrógeno por un factor de conversión.
El resultado final del análisis, es decir, el contenido de proteínas, depende de la calidad de cada paso del proceso analítico.
Digestión
La digestión se basa
en calentar la muestra con ácido sulfúrico hasta la oxidación de los compuestos
orgánicos. El nitrógeno de la muestra (orgánico) se reduce y se transforma en
sulfato de amonio (inorgánico) que es una sustancia estable. En este paso se
utiliza una mezcla catalítica con el fin de elevar la temperatura de ebullición
del ácido y aumentar la tasa de oxidación de la materia orgánica, acortando el
tiempo requerido para la digestión.
La temperatura de
ebullición del ácido sulfúrico concentrado es de cerca de 330°C, y con la
adición de una sal como el sulfato de potasio (K2SO4),
por ejemplo, la temperatura de la solución de digestión puede elevarse a 390°C
o más, dependiendo de la proporción de sal a ácido.
Durante la digestión, el carbono se transforma en dióxido de carbono (CO2) y el hidrógeno en agua (H2O). Además, el nitrógeno que existe en forma de amina, amida y nitrilo se transforma en amoníaco (NH3) que reacciona con H2SO4 y forma sulfato de amonio ((NH4)2SO4) durante la digestión, como se muestra en las reacciones a continuación, y al enfriarse, puede formar cristales (GALVANI, GAERTNER, 2006).
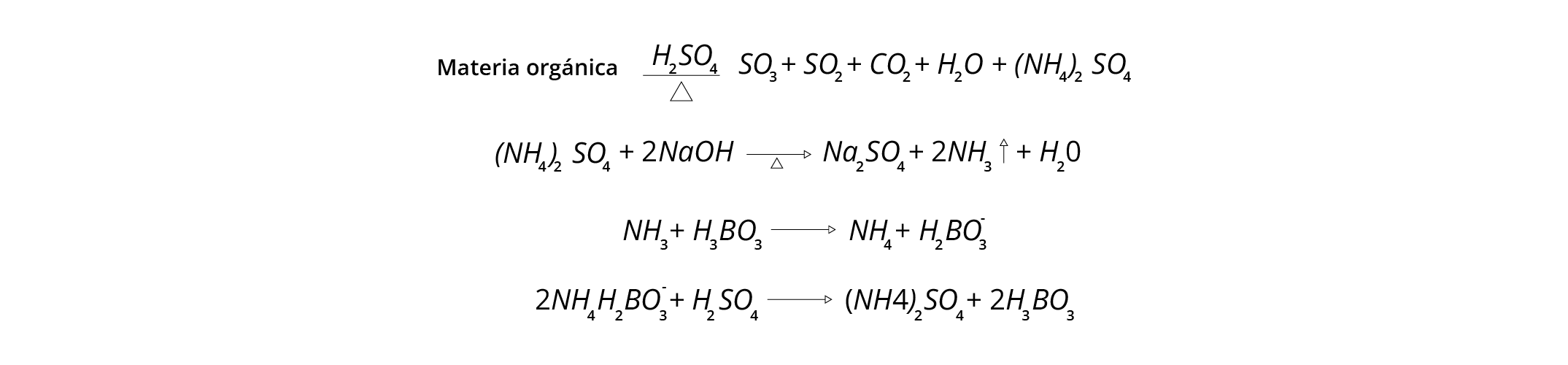
Aunque todos
los pasos son críticos para el resultado final del análisis, la digestión es
uno de los que más dudas genera sobre su ejecución. Con el objetivo de
facilitar y resolver dudas, hemos elaborado un listado de las preguntas más
frecuentes.
1) ¿Es necesario llevar a
cabo la digestión en una campana de extracción de gases?
Sí, el bloque
debe instalarse dentro de la campana. La función principal de la campana de
extracción es expulsar vapores y gases y actuar como una barrera física,
ofreciendo protección a los usuarios contra derrames de solución, vidriería
rota, manipulación de reactivos y otros problemas que pueden ocurrir durante la
digestión ácida.
2) ¿Es necesario el uso
del Scrubber seco, modelo TE-154/1, aún cuando la digestión se realiza en el interior de
la campana de extracción de gases?
De acuerdo a la respuesta anterior, la campana es la encargada de evacuar los vapores y gases tóxicos; sin embargo, solo la campana, sin la presencia de un sistema complementario, no realiza ningún tipo de neutralización o tratamiento de gases tóxicos.
El Scrubber seco garantiza
el correcto tratamiento de los gases y vapores liberados a la atmósfera,
contribuyendo a una mayor protección del medio ambiente, al minimizar los
impactos negativos.
3) ¿Qué volumen de tubo
usar?
El método
suele clasificarse en macro, semi-micro o semi-macro y micro, según la cantidad
de muestra sometida a digestión para su análisis. Los parámetros que difieren
entre sí son: masa de la muestra (que va desde miligramos a gramos o mL),
volumen de ácido sulfúrico, tamaño de la vidriería utilizada y equipos de
digestión.
Si bien la
clasificación del método dependerá de la norma o directriz adoptada, es posible
considerar la siguiente definición en relación com el tamaño de la vidriería:
· Micro: tubos com una capacidad TOTAL hasta 100mL, equivalente al Bloque de digestión micro con rampas y niveles, modelo TE-041/25, no recomendado para muestras líquidas.
Semi Micro o Semi Macro: tubos con capacidad TOTAL de aproximadamente 400 mL, equivalente al Bloque de digestión macro con touch screen, modelo TE-0081/50. Puede ser utilizado para muestras líquidas y sólidas.
Macro: digestor
tradicional de la técnica desarrollada por Johan Gustav Kjeldahl, compuesto por
matraces de capacidad TOTAL entre 500 mL y 800 mL. Se puede utilizar para muestras líquidas y
sólidas.
El factor
determinante en la elección del método Kjeldahl es el contenido de
nitrógeno en la muestra. Además, el estado físico de la muestra
(líquido o sólido) también influye en la elección del protocolo. Cabe señalar
que la cantidad de muestra a ser analizada depende del contenido de
nitrógeno esperado y del grado de homogeneidad del material.
Cuanto mayor
sea el contenido de nitrógeno de la muestra, menor será la masa de
muestra requerida y, en consecuencia, menor será el tamaño del tubo. A
continuación se ofrece una sugerencia para elegir el método o el tamaño del
bloque/tubo de digestión:
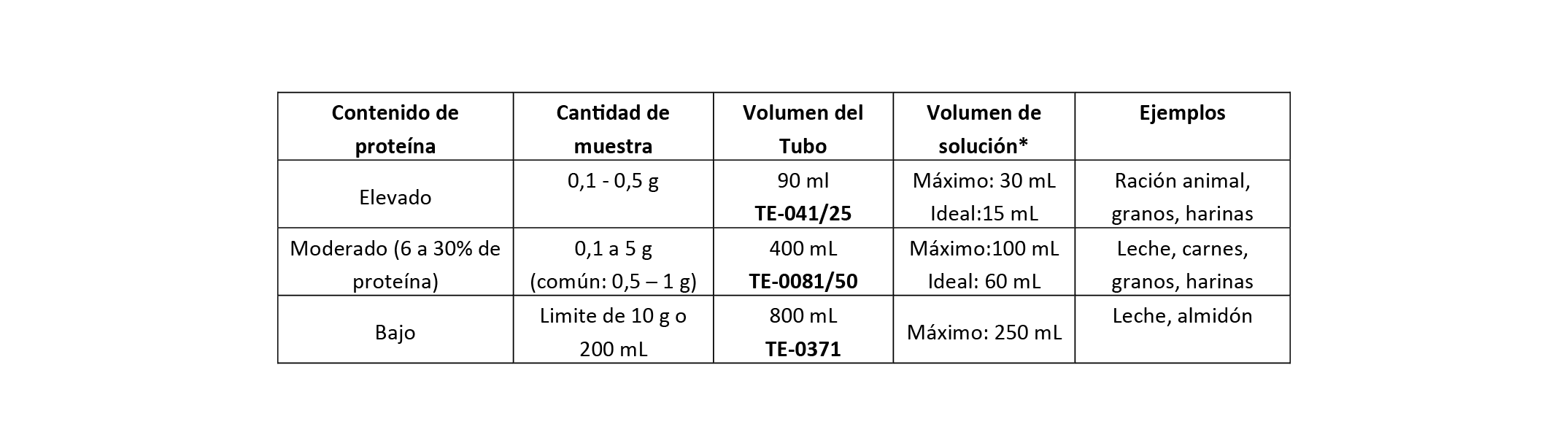
*muestra + reactivos
4) ¿Cómo calcular la masa
correcta de la muestra?
El contenido
ideal de nitrógeno oscila entre 1 y 200 mg de nitrógeno por tubo de ensayo de
vidrio.
El límite de
determinación es de 0,02 mg de nitrógeno por tubo de ensayo. Con base em estos
datos, se puede calcular la masa de muestra correcta que se va a digerir.
5) ¿Cuál es la
temperatura de calentamiento para la digestión?
La temperatura
ideal para la digestión se define según el tipo de muestra y el protocolo
adoptado. No obstante, se recomienda que no supere los 430°C. Un rango de 370
°C a 400 °C suele ser adecuado para diferentes tipos de alimentos.
A temperaturas
superiores a 390°C, la formación de nitrógeno gaseoso (N2) se
convierte en una posibilidad, ya que favorece la pérdida de nitrógeno por
pirólisis. Tal condición puede afectar la precisión del resultado final, al
reducir el contenido de nitrógeno en la muestra.
La pérdida de
nitrógeno por volatilización es una de las razones por las que el calentamiento
es gradual y no repentino.
Al comienzo de
la digestión, la reacción puede ser un poco lenta, esperándose una temperatura
más alta al final del proceso de digestión, debido al consumo gradual del
ácido. Sin embargo, factores como la entrada de calor, el consumo de ácido por
parte de la materia orgánica y la vaporización, la relación sal/ácido, el
tiempo de digestión y el tipo de frasco Kjeldahl están interrelacionados e
influyen en la temperatura final de la solución.
6)
¿Volumen de
ácido sulfúrico utilizado?
La cantidad de
ácido necesaria está influenciada por el tamaño de la muestra y la cantidad
relativa de carbono e hidrógeno en la muestra, así como la cantidad de
nitrógeno. Además, una muestra muy rica en grasas consume una mayor cantidad de
ácido.
Por lo tanto,
la cantidad de ácido a añadir inicialmente debe ser suficiente para la
digestión de la muestra sin estos interferentes y debe incrementarse a medida
que aumenta la masa de muestra y/o los interferentes.
Vale la pena
señalar que los incrementos en el volumen de ácido están previstos en los
protocolos, ya que ya han sido validados para los tipos de muestras a los que
están destinados.
7) ¿Cuál es la proporción
ideal de ácido sulfúrico y catalizador?
La relación
entre el ácido sulfúrico y las sales de sulfato es crucial para que se alcance
la temperatura de ebullición. La proporción ideal de ácido sulfúrico y
catalizador es de aproximadamente 2 mL de H2SO4 por 1 g
de catalizador.
8)
¿Cuándo
termina la digestión?
El proceso de
digestión se completa cuando el color de la muestra digerida cambia a verde o
azul claro y transparente o claro (el tono azul o verde dependerá del
catalizador utilizado). Después del cambio de color, es necesario esperar de 30
a 40 minutos para que se complete la reacción.

|
|
|
Figura 1. (A) Digestión de una muestra para la determinación del nitrógeno
total. (B) Cambio de color de la solución durante el proceso de digestión. Tomado de
Embrapa, 2016. |
Sobre Tecnal
Tecnal tiene como misión contribuir para el desarrollo científico, tecnológico y con la industria nacional e internacional por medio de la fabricación y comercialización de equipos científicos, de la prestación de servicios especializados, y de la difusión del conocimiento.
La empresa busca crecer de manera innovadora y sustentable, enfocada en la continuidad y excelencia operacional, de forma a convertirse en una referencia en el mercado brasileño e internacional de equipos científicos.
Comuníquese con nosotros: teléfono/WhatsApp +55 (19) 997441017, e-mail: comex@tecnal.com.br o por nuestra página web haciendo clic aquí.
Referencias
AOAC:
Official Methods of Analysis of the Association of Official Analytical
Chemists: Official Methods of Analysis of AOAC INTERNATIONAL, 21st Edition
(2019).
IAL,
Instituto Adolfo Lutz. Métodos físico-químicos para análise de alimentos. São
Paulo: Instituto Adolfo Lutz, p. 1020, 2008.
International
organization for standardization. Milk — Determination of nitrogen content — Part 3:
Block-digestion method (Semi-micro rapid routine method). ISO 8968-3:2004 [IDF 20-3:2004]. Geneva,2004.
GALVANI, F.; GAERTNER, E. Adequação da metodologia Kjeldahl para determinação de nitrogênio total e proteína bruta. Circular Técnica, Nº63. Corumbá: Embrapa Pantanal, 2006. p9. Disponible en: https://www.infoteca.cnptia.embrapa.br/bitstream/doc/812198/1/CT63.pdf


